[클리니컬 리포트] 뉴로벤티, NV01-A02' 2상 모집 완료 '자폐 공략' 본격화
페이지 정보
본문
[클리니컬 리포트] 뉴로벤티, NV01-A02' 2상 모집 완료 '자폐 공략' 본격화
더벨 김혜선 기자
전문 기관 8곳서 106명 모집, 3상은 파트너십 통해 추진 예정
자폐 치료제 개발 신약 벤처 뉴로벤티가 핵심 파이프라인 'NV01-A02'의 국내 임상 2상 에 속도를 내고 있다. 임상 대상자 모집을 완료한 가운데 내년 초 톱라인을 확보한다는 계획이다. 임상 결과를 기반으로 국내외 기업과의 파트너십을 추진할 방침이다.
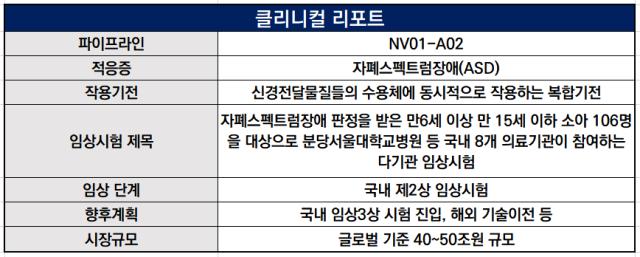
뉴로벤티는 최근 자폐스펙트럼장애(ASD) 치료제 'NV01-A02' 개발을 위한 국내 임상 2상 시험의 대상자 모집을 완료했다. 임상은 만 6세 이상에서 15세 이하의 자폐스펙트럼 장애 아동을 대상으로 한다. 8주간 투약하고 이후 4주간 추적 관찰 등을 진행한다.
임상 대상자는 전국 8개 정신건강의학과 전문 기관에서 모집한 106명이다. 기존 계획했던 임상 대상자보다 증원했다. 자폐 치료제에 대한 높은 수요가 확인되는 지점이다.
뉴로벤티는 올해 3월 첫 시험 대상자를 등록했고 이후 7월 식품의약품안전처로부터 임상 2상을 승인 받았다. 이들 대상으로 먼저 투약을 시작했고 현재 전체의 70% 규모의 임상 대상자가 투약을 완료했다.
NV01-A02는 세로토닌과 도파민의 특정 수용체를 동시에 조절하는 신약 후보물질이다. 자폐 치료제는 로슈, 애브비 등 글로벌 빅파마들도 도전한 영역이다. 그러나 현재까지 근본적인 치료제가 제한적이라 새로운 치료 옵션에 대한 시장의 관심이 높다.
뉴로벤티는 이번 임상 2상으로 기술이전 기반을 다졌다는 데 의미를 뒀다. 의대 정원 확대 관련 법안으로 임상 일정에 변동이 생길 수 있다는 우려도 있었지만 임상은 계획대로 진행됐다. 예정대로 내년 4월께 톱라인 결과를 확보할 예정이다.
서동철 뉴로벤티 대표는 "이번 임상에서는 NV01-A02에 의한 사회성 및 상동행동과 관련된 임상 지표의 변화를 평가한다"며 "투약을 완료한 인원의 지표를 살펴봤을 때 현재까지 보고된 중대한 부작용은 없으며 탈락률도 5% 이하로 나타났다"고 말했다.
이번 임상 2상을 완료하면 기술이전 등 파트너사와의 협력을 통해 임상 3상을 진행한다는 계획이다. 개발에 속도를 내고 있는 국내를 우선적으로 추진하고 이후 미국 임상을 병행한다. 미국에서는 2022년 10월 미국 식품의약국(FDA)로부터 희귀의약품에 지정됐다. 작년 7월 임상 2상 승인을 받았다.
강점은 '다중타깃' 전략이다. 기존에 개발되던 자폐치료제는 대부분 단일 타깃 물질로 효능을 내지 못했고 일부는 부작용도 발견됐다. 그러나 NV01-A02는 세로노틴 수용체 3가지, 도파민 수용체 2가지를 동시 조절한다. 사회성과 관련된 다양한 신경전달 기전의 다중 동시 조절 작용이 가능하다.
서 대표는 "국내외 제약사들도 이번 임상 결과에 주목하고 있어 향후 기술이전 논의도 활발히 진행할 수 있을 것"이라며 "이번 임상이 자폐스펙트럼장애 등 사회성장애 치료 분야에서 새로운 가능성을 제시하길 기대한다"고 말했다.
https://www.thebell.co.kr/free/content/ArticleView.asp?key=202512141700147600104443
#뉴로벤티 #neuroventi #신찬영 #자폐 #asd #자폐치료 #자폐치료제 #임상2상 #더벨 #클리니컬리포트
관련링크
- 이전글"뉴로벤티, 자폐치료 '단일분자 다중표적' 접근... 게임체인저 기대" 26.01.12
- 다음글Happy New Year! 26.01.01